
2020-03-28编辑:极客基因点击:3012
造血干细胞(Hematopoietic stem cell, HSC)位于成体造血系统的最上游,具有自我更新能力并可产生所有类型的血液细胞。目前研究认为,HSC起源于胚胎发育中期的生血内皮细胞,主要定位在主动脉-性腺-中肾(aorta-gonad-mesonephros, AGM)区的背主动脉腹侧【1】。由于数量稀少、发育时间转瞬即逝、体内功能评价系统的技术门槛较高,研究者一直未能精准捕获及分离具有HSC重建潜能的(HSC-competent)生血内皮细胞,其从原始内皮细胞逐步特化并走向HSC命运这条路径的细胞转归及分子事件仍不清晰,甚至存在争议【2,3】。
近年来研究者利用已知的生血内皮细胞转基因报告小鼠,包括Runx1 +23GFP和Gfi1-Tomato,报道了应用单细胞基因表达分析来解析内皮-造血转化事件的研究【4,5】。然而这些报告基因对于生血内皮细胞的富集效率或者特异性仍然不足。而且,这些基于选定群体的测序可能会带来研究结论的偏颇性,例如研究者认为生血内皮细胞和非生血的内皮细胞在转录组水平具有非常相似的分子特征【5】。因此,有必要对胚胎血管内皮细胞进行无偏筛选来精准识别具有HSC命运的(HSC-primed)生血内皮细胞。
刘兵/兰雨合作团队近期发表在Cell Research的研究利用单细胞转录组测序技术,从单细胞尺度解析了人类胚胎造血干祖细胞发生的细胞层级以及分子特征,并筛选获得富集生血内皮细胞的表面标志【6】。相较于人类胚胎的研究,小鼠作为重要的实验模型,具有样品来源的可控性、体内功能评价及遗传操作的可行性等诸多优势,从而使得基于重要群体捕获分离的精细体内外功能评价成为可能,这对于HSC-primed生血内皮细胞来讲尤为重要。
2020年3月20日,暨南大学基础医学院兰雨研究组、北京大学生命科学学院汤富酬研究组和解放军总医院第五医学中心刘兵研究组合作在Cell Research杂志在线发表了题为“Embryonic endothelial evolution towards first hematopoietic stem cells revealed by single-cell transcriptomic and functional analyses”的研究论文。该研究首先利用高精度的单细胞转录组测序无偏筛选了HSC发生时空的所有血管内皮细胞,鉴定出两群转录组特征不同的动脉内皮细胞并精确识别了HSC-primed生血内皮细胞;通过计算筛选得到候选表面标志组合PK44并构建了全新的基因敲入荧光报告小鼠Neurl3-EGFP,实现了HSC-competent生血内皮细胞的高效分离;进一步在单细胞转录组水平解析了从原始内皮细胞特化为HSC-primed生血内皮细胞全过程多步骤的细胞转归及分子事件。
作者首先对胚胎期(embryonic day, E)9.5到11.0天连续发育阶段胚内的血管内皮细胞进行流式分离,并通过显微操作主动脉灌注荧光染料富集了AGM区主动脉的血管内皮细胞。通过高精度的单细胞转录组测序鉴定出HSC-primed生血内皮细胞和两个时空分布相近而分子特征不同的动脉内皮细胞群体。相较于动脉内皮细胞,生血内皮细胞具有更为活跃的细胞周期和翻译活性、保留相当的动脉特征而缺乏静脉特征,这与该团队在人类胚胎中的发现一致【6】。进一步的拟时序分析发现动脉内皮细胞在HSC发生的时空具有自我成熟以及生血特化两个方向的命运。
接下来,作者通过计算筛选,结合与该团队之前鉴定功能性pre-HSC类似的体外孵育后移植系统【7】,证实在E10.0 AGM区的HSC-competent生血内皮细胞富集在CD41-CD43-CD45-CD31+CD201+Kit+CD44+(PK44)的免疫表型中。对PK44细胞的测序证实该群体很好地代表了HSC-primed生血内皮细胞群体。体外的单细胞培养发现近半数的PK44细胞具有生血潜能,其中少量细胞稳定地具有内皮和造血双向分化潜能。有趣的是,T1 pre-HSC虽然较HSC-primed生血内皮细胞在转录组水平更具造血特征,其体外的内皮分化潜能大大下降,但仍保留类似的内皮和造血双向分化潜能。
进一步,作者鉴定出11个HSC-primed生血内皮细胞的特征基因,并选取其中表达最充分的Neurl3构建了Neurl3-EGFP基因敲入荧光报告小鼠。功能学分析证实内皮细胞中Neurl3-EGFP的表达富集了HSC-competence。重要的是,该报告小鼠提供了HSC-competent生血内皮细胞的精确解剖学定位信息(图1)。通过流式比对以及index sorting策略,发现PK44是Neurl3-EGFP阳性的内皮群体中体内重建功能以及体外生血潜能和内皮造血双向分化潜能均更加富集的亚群(图2)。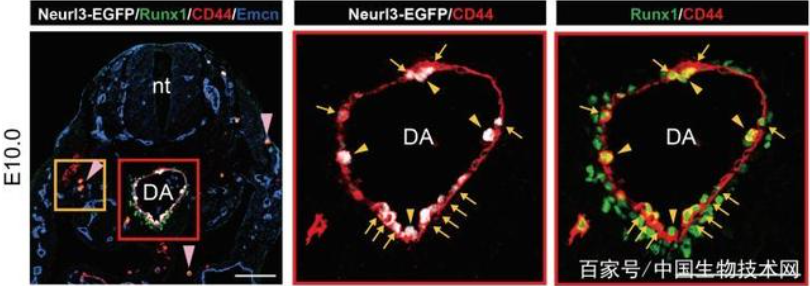
图1. Neurl3-EGFP特异性表达在主动脉的生血内皮细胞
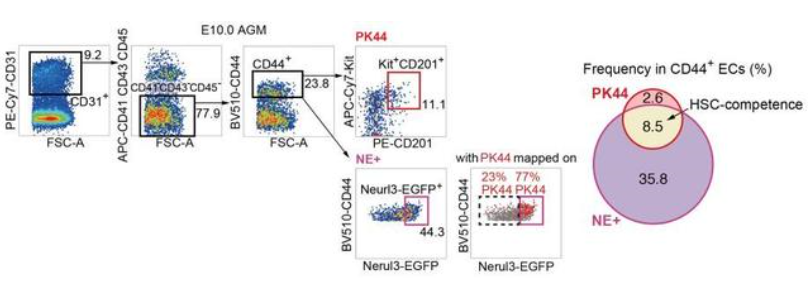
图2. PK44与Neurl3-EGFP的表达及功能相关性
为了追溯HSC-primed生血内皮细胞从原始内皮细胞起始的特化路径,作者将E8.0-9.0的早期血管内皮进行单细胞转录组测序并一同纳入研究,鉴定出新增加的早期动脉内皮和原始内皮群体。基于发育时序分析,以及细胞真实的取材时间点,可以推断出原始内皮向HSC-primed生血内皮细胞的特化过程经历了两次命运的选择,即首先选择动脉命运形成原始动脉内皮,之后再选择造血命运最终走向HSC。作者进一步解析了该特化过程中的一系列差异基因、潜在功能性转录因子、生物学过程和信号通路,揭示了该过程中波动性的基因表达模式(图3)。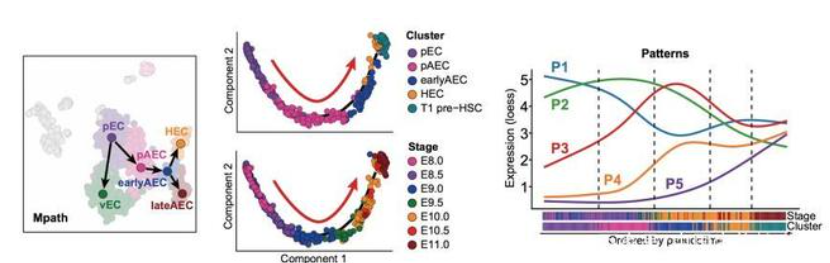
图3. 原始内皮特化为HSC-primed生血内皮的细胞及分子演进
综上所述,本研究从转录组(transcriptome)、免疫表型(immunophenotype)和功能(function)三个层面(tif)重新规范定义了生血内皮细胞,实现了较以往研究提高近20倍富集效率的生血内皮细胞捕获和分离【4】,并首次在单细胞水平证实生血内皮细胞具有内皮和造血双向分化潜能,成功构建了更加敏感和特异性标识HSC-primed生血内皮细胞的荧光报告小鼠,揭示了从原始内皮细胞到HSC-primed生血内皮细胞的两步特化路径。这些发现对HSC体内发育及体外再生研究提供了重要的理论基础、数据库资源和小鼠模型。
兰雨研究员、汤富酬研究员和刘兵研究员为该论文的通讯作者。侯思元博士、李宗城博士、郑晓娜博士、博士研究生高云、博士研究生董骥和倪艳丽硕士为该研究论文的第一作者。
原文链接:
https://www.nature.com/articles/s41422-020-0300-2
参考文献
1. Dzierzak, E. & Bigas, A. Blood Development: Hematopoietic Stem Cell Dependence and Independence.Cell Stem Cell 22, 639-651, doi:10.1016/j.stem.2018.04.015 (2018).
2. Ditadi, A., Sturgeon, C. M. & Keller, G. A view of human haematopoietic development from the Petri dish.Nat Rev Mol Cell Biol18, 56-67, doi:10.1038/nrm.2016.127 (2017).
3. Ditadi, A. et al. Human definitive haemogenic endothelium and arterial vascular endothelium represent distinct lineages.Nat Cell Biol 17, 580-591, doi:10.1038/ncb3161 (2015).
4. Swiers, G. et al. Early dynamic fate changes in haemogenic endothelium characterized at the single-cell level.Nat Commun4, 2924, doi:10.1038/ncomms3924 (2013).
5. Baron, C. S. et al. Single-cell transcriptomics reveal the dynamic of haematopoietic stem cell production in the aorta.Nat Commun9, 2517, doi:10.1038/s41467-018-04893-3 (2018).
6. Zeng, Y. et al. Tracing the first hematopoietic stem cell generation in human embryo by single-cell RNA sequencing.Cell Res 29, 881-894, doi:10.1038/s41422-019-0228-6 (2019).
7. Zhou, F. et al. Tracing haematopoietic stem cell formation at single-cell resolution.Nature533, 487-492, doi:10.1038/nature17997 (2016).
来源 中国生物技术网 中国科学院微生物研究所

关注极客基因公众号
看单细胞测序前沿资讯